提及制药行业药害事情,相信很多人都会想起2006年的欣弗事件。
2006年全国16个省区共报告“欣弗”病例93例,死亡11人。
经调查,导致这起不良事件的主要原因是,"安徽华源"2006年6月至7月生产的欣弗注射液未按批准的工艺参数灭菌,降低灭菌温度、缩短灭菌时间、增加灭菌柜装载量(该药品按规定应经过105摄氏度、30分钟的灭菌过程)。但安徽华源却擅自将灭菌温度降低到100摄氏度至104摄氏度不等,将灭菌时间缩短到1到4分钟不等,影响了灭菌效果。
经中国药品生物制品检定所对相关样品进行检验,结果表明无菌检查和热原检查不符合规定。
这是制药行业里一起触目惊心的由于质控环节失控导致的生命安全事件。那么,在制药行业,生产和质控环节应该遵循怎样的一个微生物的控制规则?
现行的2020版药典,通过“通用检测技术和标准”,”指导原则”, “制剂通则”和“品种正文”,详细指明了各种不同的制剂应该是无菌检查还是非无菌产品的微生物限度检查,生物限度同时注意对应的控制菌的检查,控制菌不得检出等作出了指导和要求。
不管是无菌检查还是微生物限度检查方法,比较常用的是薄膜过滤法和接种法,这两种方法都需要使用培养基。那么制药行业的培养基配置用水又有怎样的要求呢?
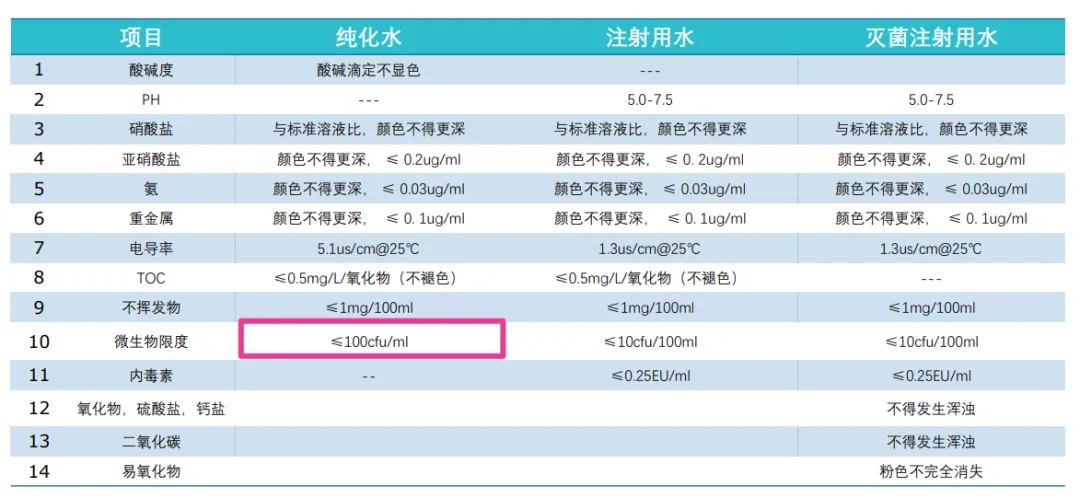
制药培养基用水标准
药典将制药用水分为四类:饮用水,纯化水,注射用水,无菌注射用水。其中药典规定了培养基的配置使用纯化水,药典二部中对纯化水的要求,其中对微生物的检测用水以及配置培养基的纯化水的要求是以≤100 cfu/ml作为一个指标。
但是我们也知道,药典的要求是作出了一个最低限度的要求,平时的水质还是得要优于药典的水平的。
为此默克做的一个实验,用不同的纯化水(去离子水,Milli-Q IX Water)去制备不同的培养基:李斯特菌培养基、紫红胆盐培养基、麦芽汁琼脂培养基等七个培养基,观察区别。结果表现如下:
这两种水制备的培养基在物理参数上(例如外观、颜色、均质性、凝胶稠度和pH值)的表现没有太大的区别。
但是不同的培养基的性能测试里,Milli-Q IX Water制备的培养基,李斯特菌回收率明显更胜一筹,而回收率是客户非常重视的一个指标。
Milli-Q IX Water的产水水质不仅符合EN ISO 11133法规的要求,各方面数值都优于或者更精准。

①游离氯小于0.22ppm;
②使用PE水箱,PE水箱是惰性材料,可溶出的物质少;
③电阻率不仅<25μS/cm,而且是<0.2μS/cm等。
所以我们会更建议客户使用Milli-Q IX Water,也就是选择默克Milli-Q带EDI纯化模块的水机(EDI:连续电流去离子)来制备培养基。不仅符合法规,水质参数更优秀,微生物回收率更好,使用的PE水箱可溶出物质更少等等。
Merck 水机中带EDI模块的水机有:
(二级水)纯水机:Elix Essencial 3/5/10/15 UV系列;Milli-Q IX 7003/7005/7010/7015系列
一体机(自来水进水,产二级纯水及超纯水):Milli-Q IQ7003/7005/7010/7015系列。
我司是Merck Milli-Q 实验室水机华南区制药行业总代,各位如有需要,欢迎垂询(020-83487199),谢谢!